A. Pengertian benzena
Benzena adalah senyawa organik siklik (berbentuk cincin)
dengan enam atom karbon yang bergabung membentuk cincin segi enam. Rumus
molekulnya adalah C6H6. Benzena termasuk dalam golongan
senyawa aromatis.
B. Struktur Benzena
Benzena pertama kali diisolasi pada tahun 1825 oleh
Michael Faraday dari residu berminyak yang tertimbun dalam pipa induk gas di
London. Kemudian pada tahun 1834 ditetapkan rumus molekul benzena adalah C6H6.
Struktur yang mula-mula diusulkan pada tahun 1865 tidak mengandung ikatan
rangkap karena benzena tidak mudah mengalami reaksi adisi seperti pada alkena.
Akan tetapi struktur yang demikian ini
tidak sesuai dengan tetravalensi karbon.
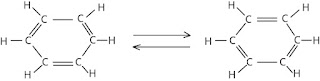
Agar tidak menyalahi tetravelensi karbon, pada tahun 1872
Friedrich August Kekule mengusulkan bahwa benzena mengandung tiga ikatan
tunggal dan tiga ikatan rangkap yang berselang-seling. Untuk
menerangkan adanya hanya tiga (tidak lima) benzena tersubstitusi, Kekule
menyampaikan bahwa cincin benzena berada dalam kesetimbangan yang cepat dengan
stuktur dalam mana ikatan rangkap berada dalam posisi alternatifnya.
Rumus struktur
di atas dapat disederhanakan penulisannya menjadi:
Pengukuran spektroskopik menunjukkan bahwa molekul
benzena adalah planar dan semua ikatan karbon-karbonnya sama panjang yaitu 1,39
Angstrom. Ikatan karbon-karbon pada benzena panjangnya di antara ikatan
karbon-karbon tunggal (1,47 Angstrom) dan ikatan karbon-karbon rangkap (1,33 Angstrom). Hal
ini dapat dibenarkan karena ikatan karbon-karbon pada benzena mengalami
resonansi (berpindah-pindah). Inilah sebabnya mengapa benzena sukar mengalami
adisi.
Energi resonansi adalah
energi yang hilang (kestabilan yang diperoleh) dengan adanya delokalisasi penuh
elektron-elektron sistem pi. Besaran ini merupakan ukuran tambahan kestabilan
sistem aromatik itu bila dibandingkan dengan sistem lokalisasi.
Ikatan karbon-karbon pada benzena terdiri atas ikatan
sigma (s ) dan ikatan phi ( p). Menurut teori ini ikatan valensi orbital molekul
terbentuk dari tumpang tindih orbital-orbital atom. Ikatan kovalen yang
terbentuk dari tumpang tindih ujung dengan ujung disebut ikatan sigma (s), sedangkan ikatan kovalen yang terbentuk dari tumpang
tindih sisi dengan sisi disebut ikatan phi (p ).
Benzena mempunyai enam karbon sp2 dalam sebuah
cincin segi enam datar. Tiap atom karbon memiliki satu orbital p yang tegak
lurus bidang cincin. Tumpang tindih keenam orbital p mengakibatkan terbentuknya
enam orbital molekul p sehingga
terbentuk awan elektron berbentuk “donat” pada bagian atas dan bawah cincin
segi enam benzena.
C. Sifat-sifat Benzena
1. Sifat-sifat
Fisis Benzena
Seperti senyawa hidrokarbon alifatis dan alisiklik, benzena dan
hidrokarbon aromatik lain bersifat nonpolar. Benzena tidak larut dalam air,
tetapi larut dalam pelarut organik, seperti dietil eter, karbon tetraklorida,
atau heksana. Benzena digunakan secara meluas sebagai pelarut. Senyawa ini
memiliki sifat yang berguna, yaitu membentuk azeotrop. Senyawa yang
larut dalam benzena mudah dikeringkan dengan menyuling azeotrop tersebut.
Meskipun titik didih dan titik leleh hidrokarbon aromatik
bersifat khas. p–xilena mempunyai titik leleh yang lebih tinggi daripada
o–xilena atau m–xilena. Titik leleh yang tinggi merupakan sifat
khas benzena p–substitusi; suatu p–isomer lebih simetris dan
dapat membentuk kisi kristal yang lebih teratur dan lebih kuat dalam keadaan padat
daripada o– dan m–isomer yang kurang simetris
2. Sifat-sifat
Kimia Benzena
Secara kimia,
benzena tidak begitu reaktif tetapi mudah terbakar dengan banyak jelaga.
Benzena lebih mudah mengalami substitusi daripada adisi.
Substitusi
Pertama
a. Halogenasi
Benzena dapat bereaksi
langsung dengan halogen dengan katalisator FeCl3 atau FeBr3.
b. Alkilasi
Benzena dapat
bereaksi dengan alkil halida membentuk alkil benzena dengan katalisator AlCl3.
c. Nitrasi
Benzena
bereaksi dengan asam nitrat pekat dengan katalisator asam sulfat pekat
menghasilkan nitro benzena.
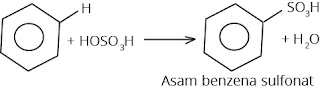
d. Sulfonasi
Benzena yang
dipanaskan dapat bereaksi dengan asam sulfat pekat menghasilkan asam benzena
sulfonat.
e. Asilasi
Asilasi benzena
dengan senyawa halida asam yang mengandung gugus asil, R–CO– atau Ar–CO– disebut
reaksi asilasi aromatik atau asilasi Friedel-Crafts.
D. Pembuatan Benzena
Benzena dapat
dibuat dengan beberapa cara ,yaitu:
1. Polimerisasi
asetilena, yaitu dengan mengalirkan asetilena melalui pipa kaca yang pijar.
Atau ditulis:
3C2H2 → C6H6
2. Memanaskan
kalsium benzoat dengan kalsium hidroksida.
Ca(C6H5COO)2
+ Ca(OH)2 → 2C6H6 + 2CaCO3
3. Dengan
destilasi bertingkat tir batu bara.
Pada destilasi
bertingkat tir batu bara selain dihasilkan benzena juga diperoleh zat-zat lain,
misalnya tokrena, xilena, naftalena, antrosena, fenantrena, fenol, dan kresol.
4. Dengan
proses reforming nafta pada industri petrokimia.
E. Turunan Benzena
Turunan benzena
atau derivat benzena diperoleh dari penggantian satu atom H atau lebih dari
inti benzena dengan gugus-gugus lain.
Tata Nama
Turunan Benzena
1. Benzena pada
umumnya dipakai sebagai induk dan gugus yang terikat disebutkan lebih dulu
kemudian diikuti dengan benzena.
Contoh:
Beberapa
senyawa turunan benzena mempunyai nama khusus yang lebih lazim digunakan.
2. Untuk dua
subtituen posisinya dapat diberi awalan : orto (o) untuk posisi 1 dan 2,
meta (m) untuk posisi 1 dan 3 dan para (p) untuk posisi 1 dan 4.
contoh:
3. Gugus
bervalensi satu yang diturunkan dari benzena disebut fenil dan gugus yang diturunkan
dari toluena disebut benzil.
4. Untuk tiga
substituen atau lebih, awalan orto, meta, dan para tidak diterapkan lagi,
tetapi posisi substituen yang dinyatakan dengan angka, urutan prioritas
penomoran adalah sebagai berikut.
– COOH, – SO3H,
– CHO,– CN, – OH, – NH2, – R, – NO2, – X
Contoh:
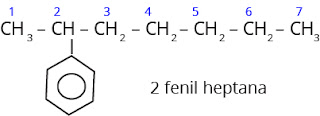
5. Bila cincin
benzena terikat pada rantai alkana bergugus fungsi atau rantai alkana dengan 7
atom karbon atau lebih maka rantai alkana tersebut sebagai induk, sedangkan
cincin benzena sebagai substituen.
Substitusi
kedua
Benzena yang telah tersubstitusi dapat mengalami
substitusi kedua. Gugus (substituen) pertama dapat memengaruhi kereaktifan
(laju reaksi) dan posisi substituen pada substitusi kedua.
Contoh:
Substitusi
kedua pada anilin oleh Br2 berlangsung cepat tanpa katalis daripada
benzena.
Substitusi
kedua pada nitrobenzena harus dengan katalis, temperatur tinggi, dan waktu yang
lebih lama daripada benzena.
Beberapa
substituen pertama sebagai pengarah, substituen kedua pada posisi orto dan
para, serta beberapa substituen pertama sebagai pengarah pada posisi meta.
Contoh:
Substituen Cl
pengarah posisi orto dan para, sedangkan substituen NO2 pengarah posisi meta.
F. Kegunaan Benzena dan Turunannya yang Penting
1.
Benzena
Benzena digunakan sebagai pelarut untuk
berbagai jenis zat. Selain itu benzena juga digunakan sebagai bahan dasar
membuat stirena (bahan membuat sejenis karet sintetis) dan nilon–66.
2. Halogen
Benzena
Digunakan dalam
industri cat, pembuatan zat-zat lain dan pembuatan insektisida (DDT).
3. Nitro
Benzena
Nitro benzena
digunakan untuk pembuatan anilin dan bahan peledak (TNT = 2,4, 6– trinitro
toluena).
4. Asam Benzena
Sulfonat
Asam benzena
sulfonat digunakan untuk membuat zat-zat karena mudah larut dalam air, dan
pembuatan obat-obat sulfa. Turunan asam benzena sulfonat yang terkenal adalah
sakarin.
5.
Anilina
Anilina merupakan bahan dasar untuk
pembuatan zat-zat warna diazo. Reaksi anilina dengan asam nitrit akan
menghasilkan garam diazonium, dan proses ini disebut diazotisasi.
6. Fenol
Fenol (fenil alkohol) dalam kehidupan
sehari-hari lebih dikenal dengan nama karbol atau lisol, dan dipergunakan
sebagai zat disinfektan (pembunuh bakteri) karena dapat menyebabkan denaturasi
protein, selain itu juga untuk pembuatan obat-obatan, bahan peledak, dan plastik.
7. Asam Benzoat
Asam
benzoat digunakan sebagai pengawet pada berbagai makanan olahan.
8. Stirena
Jika stirena mengalami polimerisasi akan
terbentuk polistirena, suatu jenis plastik yang banyak digunakan untuk membuat
insulator listrik, boneka-boneka, sol sepatu, serta piring dan cangkir.
9. Benzaldehida
Benzaldehida
digunakan sebagai zat pengawet, zat warna, serta sebagai
bahan baku pembuatan parfum karena memiliki bau yang sedap.
10.
Asam Salisilat
Asam
salisilat adalah nama lazim dari asam o–hidroksibenzoat. Ester dari asam
salisilat dengan asam asetat digunakan sebagai obat dengan nama aspirin atau
asetosal.
11.
Toluena
Kegunaan
toluena yang penting adalah sebagai pelarut dan sebagai bahan baku pembuatan
zat peledak trinitrotoluena (TNT).
12.
Natrium Benzoat
Seperti
asam benzoat, natrium benzoat juga digunakan sebagai bahan pengawet makanan
dalam kaleng.
G. Pembuatan Beberapa Turunan Benzena yang Penting
1. Alkil
Benzena
Diperoleh
menurut sintesis Friedel Crafts
2. Halogen
Benzena
3. Nitro
Benzena
Diperoleh
dengan nitrasi benzena.
4. Asam Benzena
Sulfonat
Diperoleh
dengan mereaksikan benzena dengan asam sulfat (sulfonasi).
5. Anilin
Diperoleh
dengan mereduksi nitro benzena atau dari halogen benzena.
atau
6. Fenol
Dibuat dengan
memanaskan asam benzena sulfonat dalam alkali atau memanaskan halogen benzena
dalam alkali.
7. Asam Benzoat
Dibuat dengan
cara mengoksidasi toulena.
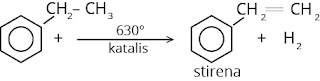
8. Stirena
Diperoleh
dengan dehidrogenasi etil benzena dengan katalis seng atau Cr2O3.
9. Benzaldehid
Diperoleh dari
oksidasi toluena.

























EmoticonEmoticon